4.1. 8
Maxwellovo rozdelenie molekúl podľa rýchlostí
V plyne v dôsledku chaotického pohybu častíc a zrážok medzi nimi sa ustáli rovnovážny stav, ktorý sa prejavuje rovnomerným rozdelením teploty a koncentrácie častíc v nádobe. Jednotlivé častice sa pohybujú rôznymi smermi a môžu mať rôzne rýchlosti v. Pravdepodobnosť toho, že častica má rýchlosť v intervale hodnôt v až (v+dv) je úmerná (pozri § 4.1.7)
![]() .
.
Plyn je ideálny,
jeho častice nemajú potenciálnu energiu a nepredpokladáme existenciu
vonkajšieho silového poľa. Potom z celkovej mechanickej energie častice
ostáva len kinetická energia. Ak je N
počet všetkých častíc v objeme, potom dN
je počet častíc s rýchlosťami v uvedenom intervale. Ak by sme kreslili pre
jednotlivé častice (ktoré majú rýchlosť v rámci tohoto intervalu) ich
vektory v z jedného bodu, tak ich
konce by boli v guľovej vrstve s polomerom v
a hrúbkou dv. Objem tejto vrstvy
je 4pv2
dv. Počet častíc s takýmito rýchlosťami je úmerný celkovému počtu častíc
v objeme, hrúbke guľovej vrstvy a pravdepodobnosti výskytu rýchlostí
v intervale v až v+dv
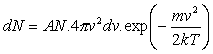 , (a)
, (a)
kde A je koeficient úmernosti. Po výpočtoch prídeme k
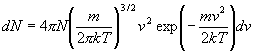 (4.1.22)
(4.1.22)
Toto je Maxwellovo rozdelenie častíc plynu podľa rýchlostí. Vzťah nám udáva koľko častíc plynu má pri teplote plynu T rýchlosť v intervale od v do v+dv. Výraz
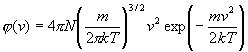 (4.1.23)
(4.1.23)
je Maxwellova rozdeľovacia funkcia. Keďže kinetická energia častice plynu súvisí s jej rýchlosťou, je možné rozdelenie podľa rýchlostí prepočítať na rozdelenie podľa energií (príklad 4.1.8.2).
Hodnota najpravdepodobnejšej
rýchlosti je
![]() . (4.1.24)
. (4.1.24)
Výpočet najpravdepodobnejšej energie je v príklade 4.1.8.3.
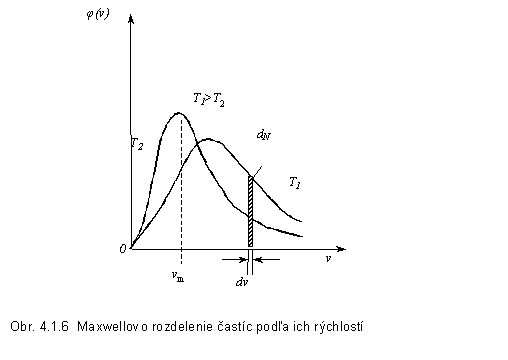
Grafické znázornenie Maxwellovej rozdeľovacej funkcie je na
obr.4.1.6. Plochy ohraničené krivkami
a vodorovnou osou sú rovnaké a rovné počtu všetkých častíc N. Vo vyšrafovanom pásiku je dN častíc, ktoré majú rýchlosti od v do v + dv. Z grafu vidno, že pravdepodobnosť nulovej rýchlosti častice
je nulová, čo znamená, že pri nijakej teplote sa nezastaví tepelný pohyb častíc
plynu. Tiež vidíme, že čím je teplota plynu vyššia, tým sa závislosť stáva
viac plochou a najpravdepodobnejšia
rýchlosť nadobúda vyššie hodnoty,
t.j. viac častíc má vysoké rýchlosti. Graf nie je symetrický, čo
znamená, že najpravdepodobnejšia rýchlosť vm
nebude totožná so strednou rýchlosťou ![]() ani so strednou kvadratickou rýchlosťou vk..
Najjednoduchšie je získať strednú kvadratickú rýchlosť zo (4.1.4):
ani so strednou kvadratickou rýchlosťou vk..
Najjednoduchšie je získať strednú kvadratickú rýchlosť zo (4.1.4):
![]() ,
,
odkiaľ
![]() .
.
Potom
![]() (4.1.25)
(4.1.25)
a stredná rýchlosť (príklad 4.1.8.1)
![]() . (4.1.26)
. (4.1.26)
_______________________
Príklad
4.1.8.4
Predstavte si, že máme plyn, častice ktorého sa môžu
pohybovať len v rovine (tzv. dvojrozmerný plyn). Odvoďte vzťah analogický
vzťahu (4.1.22).
Riešenie:
Postupujeme úplne rovnako ako v § 4.1.8, s tým
rozdielom, že konce vektorov rýchlostí nebudú v guľovej vrstve, ale
v medzikruží. Pri výpočte integrálu použijeme vzorec
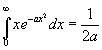 .
.
Výsledný vzťah je
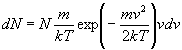 .
.
__________________________